Technische und methodische Entwicklung für die hochmoderne Proteomanalyse
Im Vorfeld von massenspektrometrischen Analyse mit LC-MS/MS-Systemen für sensitive und umfassende Proteomanalysen ist die Probenvorbereitung entscheidend. Zu diesem Zwecke haben wir eine Vielzahl von geeigneten Protokollen entwickelt und angepasst. Ihre Nutzung ermöglicht uns die Charaktersisierung der Proteome unterschiedlichster Mikroorganismen im Rahmen unserer eigenen Forschung oder in Zusammenarbeit mit unseren zahlreichen nationalen und internationalen Partnern.
Einige Beispiele dafür sind:
Reinigung und Anreicherung von extrem verdünnten Proteomproben
Wir haben erfolgreich ein Protokoll für die Anreicherung von hochverdünnten Proben entwickelt, mit denen auch Proteine aus Körperflüssigkeiten oder ins Wachstumsmedium sekretierte Proteine analysiert werden können. Die Methode basiert auf handelsüblichen Affinitätskügelchen, die zu diesem Zwecke in geeigneter Weise vorbereitet werden müssen. Zusätzlich zur Anreichung verdünnter Proteine ist auch eine sensitive Reinigung von Proteomproben möglich um beispielsweise Salze oder Nukleinsäuren zu entfernen, die anderenfalls die nachfolgenden massenspektrometrischen Untersuchungen stören können. Eine weitere bemerkenswerte Eigenschaft dieses Reinigungsprotokolls ist die Möglichkeit Proteomproben ohne komplizierte Kühlungslogistik zu lagern und zu versenden.
- Bonn et al. PMID: 24987932.
Entwicklung von Anreicherungsmethoden für bakterielle Membranen
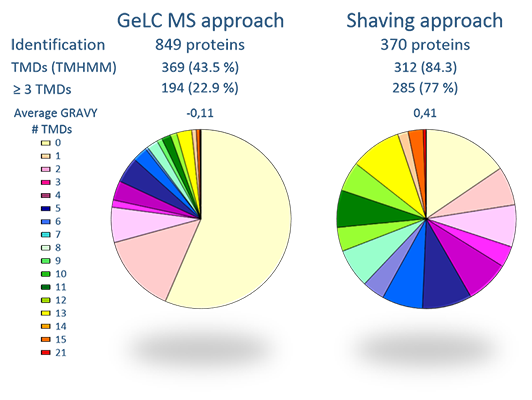
Obwohl in den meisten Mikroorganismen ein Drittel des Genoms für vorhergesagte Membranproteine kodiert, sind diese speziellen Proteine in Proteomstudien üblicherweise unterrepräsentiert. Der Grund für dieses Defizit beruht hauptsächlich auf der Hydrophobizität dieser Proteinklasse, die zu einer Inkompatibilität mit den üblichen biochemischen Puffern und der physikochemischen Beschränkung der 2D-Gel basierten Proteomtechniken führt. Um das Membranproteom der Mikroorganismen zugänglich zu machen, haben wir Protokolle etabliert und (weiter)entwickelt, die sowohl Proteine der inneren Membran als auch membran-assoziierte Proteine in Proteomproben anreichert und eine LC-MS/MS-Analyse für unterschiedliche Gruppen von Membranproteinen ermöglicht.
- Wolff et al. PMID: 18460691.
- Dreisbach et al. PMID: 18491319.
- Wolff et al. PMID: 18460691.
- Hahne et al. PMID: 18763711.
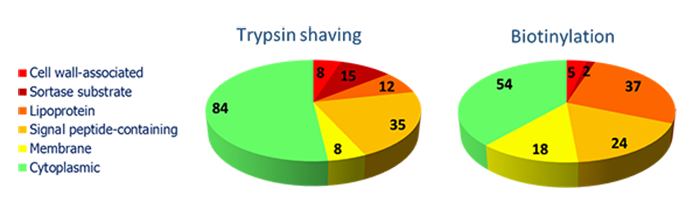
Analyse der Bakterienoberfläche
Auf der Bakterienoberfläche finden sich zahlreiche Proteine mit unterschiedlichen physikochemischen Eigenschaften: Membranproteine, Lipoproteine und Proteine, die kovalent oder nicht-kovalent an die Zellwand gebunden sind. Wir haben verschiedene Protokolle für diese spezielle Proteomanalysen entwickelt; beispielsweise für die spezifische Markierung der oberflächen-assoziierten Proteine durch Biotinylierung oder die direkte enzymatische Umsetzung von Proteinen, die an die Oberfläche assoziiert sind.
- Hempel et al. PMID: 20108986.
- Dreisbach et al. PMID: 21674804.